


 微信在线咨询
微信在线咨询


| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| C0019S | 乳酸脱氢酶释放检测试剂盒(WST-8法) | 100次 | 266.00元 |
| C0019M | 乳酸脱氢酶释放检测试剂盒(WST-8法) | 500次 | 726.00元 |
碧云天的乳酸脱氢酶释放检测试剂盒(WST-8法) (LDH Release Assay Kit with WST-8),也称乳酸脱氢酶检测试剂盒(WST-8法) (LDH Assay Kit with WST-8)、乳酸脱氢酶细胞毒性检测试剂盒(WST-8法) (LDH Cytotoxicity Assay Kit with WST-8)或乳酸脱氢酶活性检测试剂盒(WST-8法) (LDH Activity Assay Kit with WST-8),是一种基于WST-8的显色反应,通过比色法快速、高灵敏地检测细胞坏死(Necrosis)等细胞膜完整性受损时释放的乳酸脱氢酶(Lactate dehydrogenase, LDH)活性或检测其它样品中的LDH活性的试剂盒。
本试剂盒用于以LDH释放为指标的细胞毒性检测,也可以用于常规的乳酸脱氢酶活性的检测。
LDH是绝大部分哺乳动物活细胞中都存在的酶,广泛存在于哺乳动物各个组织中,以心、骨骼肌和肾脏通常最为丰富,是临床心肌酶谱检查中的一项重要指标,可用于心肌疾病的辅助诊断。LDH催化乳酸(Lactate)生成丙酮酸(Pyruvate),同时伴随着NAD+到NADH的转化。由于其常在组织损伤期间释放(通常因为细胞膜失去完整性而导致细胞内LDH的释放),因此也被视作细胞坏死和常见损伤和相关疾病的生物标志物[1, 2]。
细胞死亡包括凋亡(Apoptosis)、坏死(Necrosis)、焦亡(Pyroptosis)等多种形式。其中受调控的细胞死亡被称为程序性细胞死亡(Programmed cell death, PCD),而不受调控的细胞死亡被称为坏死。细胞坏死(Necrosis)或者细胞凋亡(Apoptosis)的继发性坏死(Secondary necrosis)、焦亡(Pyroptosis)等造成的细胞膜结构的破坏会导致细胞内的酶释放至细胞外,其中包括酶活性较为稳定的LDH。如果是培养的细胞就会释放到培养液里;如果是活体动物就会释放到组织微环境并很可能进入血液。对于培养的细胞,通过检测从质膜破裂的细胞中释放出来的LDH的活性,就可以实现对细胞毒性的定量分析。LDH释放被认为是细胞膜完整性的重要指标,并被广泛用于细胞坏死等细胞膜完整性受损的检测。LDH释放被认为是以前使用放射性的51Cr标记细胞,随后通过51Cr释放进行细胞膜完整性检测的安全有效的替代方法[3]。
LDH活性有多种比色测定方法如DNP法、INT法、WST-8法等。DNP法即2,4-二硝基苯肼法,其原理是LDH催化乳酸生成丙酮酸,丙酮酸和2,4-二硝基苯肼(2,4-dinitrophenylhydrazine)反应,生成二硝基苯腙(2,4-dinitrophenylhydrazone),在碱性溶液中呈棕红色,其颜色深浅与LDH量成正比。DNP法步骤较为繁琐,一般较为少用。INT法,如碧云天乳酸脱氢酶细胞毒性检测试剂盒(C0016/C0017),是基于在LDH的作用下,NAD+被还原生成NADH,NADH和INT (2-p-iodophenyl-3-nitrophenyl tetrazolium chloride)被硫辛酰胺脱氢酶(Diaphorase)催化反应生成NAD+和强生色物甲臜(Formazan)。
本试剂盒采用的是WST-8法,和INT法相比,通常检测灵敏度更高,吸光度变化更大,检测结果更准确。
本试剂盒既可以检测D-LDH,也可以检测L-LDH,或两者的混合物。
本试剂盒的基本原理如下。在LDH的作用下,NAD+被还原生成NADH,NADH和WST-8反应生成NAD+和水溶性的甲臜染料(Formazan dye),在450nm波长下产生吸收峰,从而可以通过比色来定量LDH的活性。吸光度与LDH活性成线性正相关。该酶联反应原理的示意图如下(图1)。
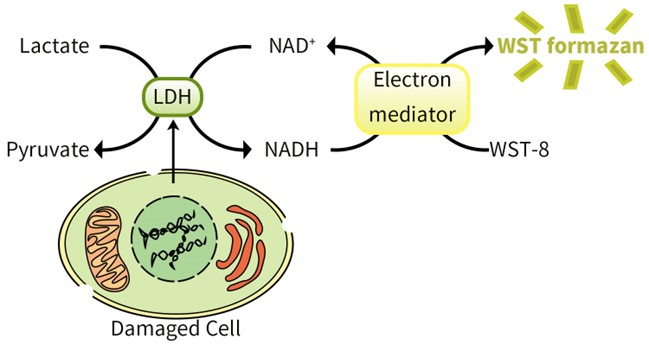
图1.碧云天乳酸脱氢酶释放检测试剂盒(WST-8法) (C0019)检测原理图。
本试剂盒检测灵敏度高,线性范围宽。在样品体积为100μl时,可检测活力低至0.15mU/ml的乳酸脱氢酶,在0.15-50mU/ml活力范围内有良好的线性关系。本试剂盒提供了乳酸脱氢酶标准溶液,可以通过绘制标准曲线(图2),计算出样品中的乳酸脱氢酶的活性。
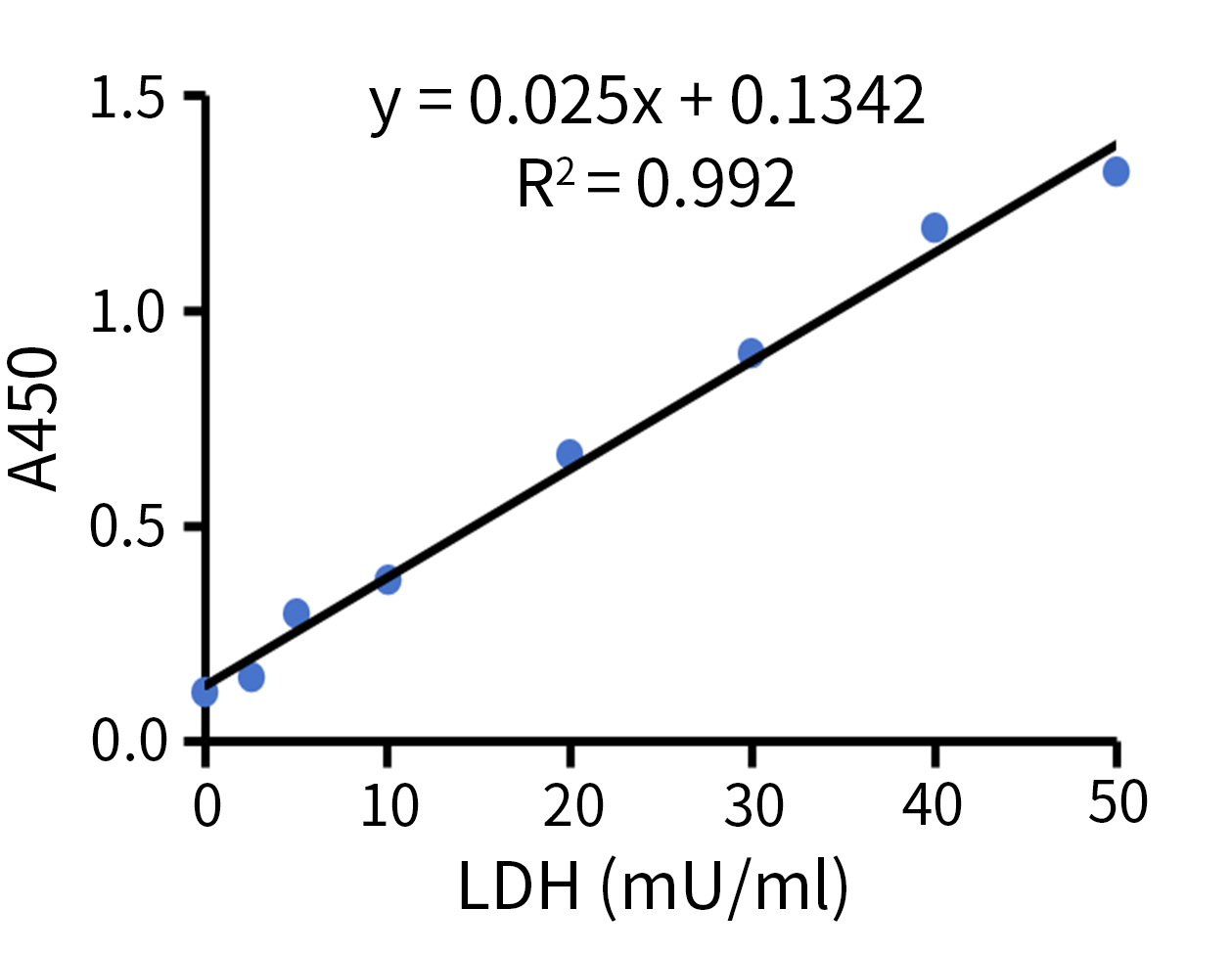
图2.碧云天乳酸脱氢酶释放检测试剂盒(WST-8法) (C0019)对乳酸脱氢酶标准品的检测效果图。各浓度的LDH标准品加入LDH检测工作液后,37ºC孵育30分钟,测定A450,在0.15-50mU/ml范围内有良好的线性关系。实际检测数据会因检测仪器、实验条件等的不同而存在差异,本图仅供参考。
本试剂盒可检测细胞培养液、细胞裂解液等样品中LDH的活性。
按照使用说明推荐的使用量进行检测,本产品小包装可进行100次检测,中包装可进行500次检测。
包装清单:| 产品编号 | 产品名称 | 包装 |
| C0019S-1 | LDH Release Assay Buffer | 20ml |
| C0019S-2 | Chromogen Solution | 1ml |
| C0019S-3 | Lactate Dehydrogenase (2.5U/ml) | 50μl |
| C0019S-4 | Stop Solution | 2.2ml |
| - | 说明书 | 1份 |
| 产品编号 | 产品名称 | 包装 |
| C0019M-1 | LDH Release Assay Buffer | 100ml |
| C0019M-2 | Chromogen Solution | 5ml |
| C0019M-3 | Lactate Dehydrogenase (2.5U/ml) | 250μl |
| C0019M-4 | Stop Solution | 12ml |
| - | 说明书 | 1份 |
-20ºC保存,一年有效。Chromogen Solution须避光保存。试剂盒解冻后可以短期4ºC存放,2-3天内有效。
注意事项:冷冻会使样品中部分乳酸脱氢酶失活,样品在4ºC可放置2-3天。建议样品准备好后尽量当天完成测定。
LDH Release Assay Buffer需要完全解冻并平衡至室温后再使用,否则会影响检测结果。其它溶液使用时应在冰上进行。
在检测细胞培养液中的乳酸脱氢酶时,由于血清含有乳酸脱氢酶,使用含血清的培养液会增加背景读数,在检测时一定要设置没有细胞,但加入了相同体积培养液的对照孔,以用于消除背景。血清含量越高,背景值越高。如果对于实验无明显影响,建议使用灭活血清,这样血清中的乳酸脱氢酶会被很大程度上失活,大幅降低背景。如果对于实验无明显影响,实验时可以使用无血清培养液或血清浓度较低的培养液,这样能有效降低血清中乳酸脱氢酶的本底活性。
细胞过度生长、密度过高、离心速度过大、培养箱内外温差过大,都会造成细胞释放乳酸脱氢酶增加。此外,不同的细胞乳酸脱氢酶的含量也存在一定差异。
未加终止液时,随着时间延长,吸光值会逐渐增大。加入终止液后,显色可以稳定保存48小时。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
| Samples | 1 | 10 | 20 | 50 |
| LDH Release Assay Buffer | 91μl | 910μl | 1820μl | 4550μl |
| Chromogen Solution | 9μl | 90μl | 180μl | 450μl |
| LDH Assay Working Solution | 100μl | 1ml | 2ml | 5ml |
| 产品编号 | 产品名称 | 包装 |
| C0016/C0017 | 乳酸脱氢酶细胞毒性检测试剂盒 | 100次/500次 |
| C0018 | 乳酸脱氢酶细胞毒性检测试剂盒(WST-8法) | 100次/500次 |
| C0019 | 乳酸脱氢酶释放检测试剂盒(WST-8法) | 100次/500次 |
| P0392S | D-乳酸脱氢酶检测试剂盒(WST-8法) | 100次 |
| P0393S | L-乳酸脱氢酶检测试剂盒(WST-8法) | 100次 |
| P0395S | 总乳酸脱氢酶检测试剂盒(WST-8法) | 100次 |









 微信在线咨询
微信在线咨询











