使用说明:
1.DNA模板的准备:
本试剂盒体外转录的DNA模板需要是带有SP6 Promoter的线性化质粒DNA、PCR产物或合成的DNA片段等。正义或反义RNA的合成取决于插入序列的方向。将靶序列置于SP6 Promoter的下游,在转录时将以双链DNA的反义链为模板转录获得正义RNA,即转录获得的RNA的序列对应于插入的DNA片段的正义链(参考图2)。在体外转录时,推荐的模板DNA浓度为1µg/µl,模板可以用水或TE缓冲液溶解。
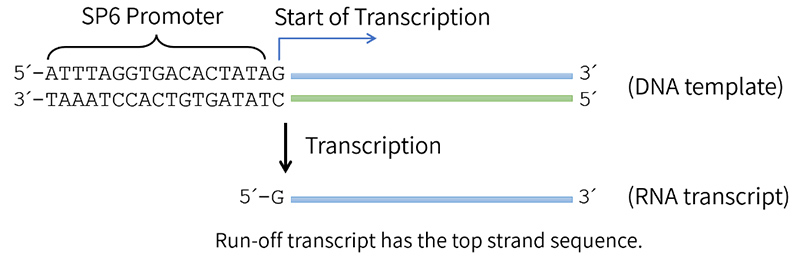
图2.SP6 RNA聚合酶催化的基于SP6 Promoter的RNA转录反应示意图。其中SP6 Promoter之前可以有更多的序列。
a.质粒DNA模板的准备。
携带SP6 Promoter的线性化质粒可以作为转录模板。抽提获得高纯度质粒DNA后,用适当的内切酶消化过夜,然后进行DNA柱纯化或酚氯仿抽提和乙醇沉淀。在质粒DNA内切酶消化过夜后进行DNA凝胶电泳和切胶回收线性化质粒DNA的效果通常是比较理想的选择。确保获得线性质粒DNA的更有效方式是,在酶切位点处插入一段比较大的DNA片段,后续双酶切去除该大片段,同时确保酶切后的位点刚好在所需位点处,这样后续通过凝胶电泳很容易回收获得高纯度的线性化质粒DNA模板。
注1:质粒的线性化程度和纯度都会影响RNA转录产物的产量以及完整性。
注2:为了产生确定长度的RNA转录产物,质粒DNA需要通过限制性内切酶消化在待转录插入片段的下游进行线性化处理。线性化质粒DNA作为模板时要尽量避免3’端突出(3’ overhang),即尽量确保是平末端或5’端突出(5’ overhang)。如果出现3’端突出的情况,模板DNA需要用Klenow片段或T4 DNA Polymerase处理成平末端后再进行转录反应或者需要重新设计质粒线性化的酶切位点。
注3:由于SP6 RNA Polymerase的高聚合力,与线性DNA模板相比,环状质粒模板会产生更长的异质化的RNA转录产物。因此,重要的是要把环状质粒充分线性化或者线性化后进行凝胶电泳和胶回收以获得高纯度的线性化DNA模板,从而确保转录产物长度和预期的完全一致。
注4:以线性化质粒DNA作为模板时,每个20微升反应体系建议使用1µg的线性化质粒DNA。质粒线性化后,需要纯化后再作为体外转录的模板,这样可以避免酶、蛋白、盐等的残留对转录体系的影响。
b.PCR产物模板的准备。
携带SP6 Promoter的PCR产物可以作为体外转录的模板。在PCR扩增模板时将SP6 Promoter (ATTTAGGTGACACTATAG)加在上游引物的5’端。转录前,建议对PCR产物进行琼脂糖凝胶电泳,以评估PCR反应的特异性和产量。尽管可以直接使用PCR产物作为模板,但使用纯化的PCR产物往往可获得更高的产量。根据PCR产物长度的不同,在20μl体外转录反应中可以使用0.1-0.5μg PCR产物。
c.合成的DNA模板
合成的带有SP6 Promoter的双链(通常通过退火反应获得)可以作为体外转录的模板,或者合成的仅SP6 Promoter为双链而其余的反义链为单链的DNA片段也可以作为体外转录的模板。
2.RNA的体外转录。
a.解冻必要的试剂盒组分,混匀后快速离心一下,将溶液沉淀至离心管底部。如果需进行多个反应,除模板外可以进行预混和再分装到各个反应管内,同时在配制预混液时需要注意把RNase Inhibitor和SP6 RNA Polymerase在其它组分混合后再最后加入。反应体系通常为20μl,但可以根据需要按比例扩大反应体系。
b.参考下表设置反应体系。混匀后快速离心一下,将溶液沉淀至离心管底部。37℃孵育2小时或更长时间。
| Reagent |
Volume |
Final Concentration |
| Nuclease-free Water |
(11.5-x)µl |
- |
| SP6 Reaction Buffer (10X) |
2μl |
1X |
| ATP (100mM) |
1μl |
5mM |
| GTP (100mM) |
1μl |
5mM |
| UTP (100mM) |
1μl |
5mM |
| CTP (100mM) |
1μl |
5mM |
| Template DNA |
xµl |
0.05µg/μl |
| RNase Inhibitor |
0.5µl |
- |
| SP6 RNA Polymerase |
2µl |
- |
| Total Volume |
20µl |
- |
注1:孵育时长取决于模板量、模板的纯度和转录产物长度。对于转录物长度超过0.3kb的反应,通常37℃孵育2小时就可以获得接近最大的产量。对于转录物长度小于0.3kb的反应,可以在37℃孵育4小时或过夜,以获得更多的转录产物。如果希望获得更多的转录产物,可以尝试把NTP的浓度加倍。
注2:对于孵育60分钟或更短时间的情况,可以使用水浴;对于孵育超过60分钟的情况,建议使用PCR仪以防止样品蒸发。
c.DNase处理去除DNA模板。常规的反应体系通常会产生浓度高达5μg/μl的RNA,反应混合物会略有粘稠,适当稀释反应混合物后,更容易进行DNase处理。如果需要消化去除模板DNA,可以在20μl反应体系中加入30μl Nuclease-free Water和1μl本试剂盒提供的DNase I,混匀后快速离心一下,将溶液沉淀至离心管底部。37℃孵育15分钟。
d.转录产物的纯化和凝胶电泳检测。通过酚氯仿抽提后乙醇或异丙醇沉淀RNA以纯化转录产物,或者使用适当的柱纯化方法纯化体外转录获得的RNA。可以通过常规的RNA电泳确认获得的转录产物的长度和纯度。
3.加帽RNA的合成(须自备Cap Analog
)。
a.解冻必要的试剂盒组分,混匀后快速离心一下,将溶液沉淀至离心管底部。
b.准备浓度为40mM的帽类似物(Cap Analog),如m7(3’-O-methyl)-G(5’)ppp(5’)G,也被称为Anti-reverse cap analog (ARCA)。
c.参考下表,设置反应体系。
| Reagent |
Volume |
Final Concentration |
| Nuclease-free Water |
(10.3-x)µl |
- |
| SP6 Reaction Buffer (10X) |
2μl |
1X |
| ATP (100mM) |
1μl |
5mM |
| UTP (100mM) |
1μl |
5mM |
| CTP (100mM) |
1μl |
5mM |
| GTP (100mM) |
0.2μl |
1mM |
| Cap Analog (40mM) |
2μl |
4mM |
| Template DNA |
xµl |
0.05µg/μl |
| RNase Inhibitor |
0.5µl |
- |
| SP6 RNA Polymerase |
2µl |
- |
| Total Volume |
20µl |
- |
d.混匀后快速离心一下,将溶液沉淀至离心管底部。37℃孵育2小时。
注:每个反应体系的产量约为20-40μg RNA,大约80%的RNA转录产物被加帽。改变帽类似物与GTP的比例对RNA产量的影响如下表所示。增加帽类似物与GTP的比例将提高加帽RNA转录产物的比例,但是也会显著降低转录反应的产量。优选推荐使用帽类似物与GTP的摩尔比为4:1。
| Cap Analog & GTP Ratio |
Cap Analog (mM) |
GTP (mM) |
RNA Yield (μg) in 2 h |
Capped RNA (%) |
| 0:1 |
0:5 |
100 |
0 |
0:1 |
| 1:1 |
2.5:2.5 |
70 |
50 |
1:1 |
| 2:1 |
3.3:1.7 |
50 |
67 |
2:1 |
| 4:1 |
4:1 |
30 |
80 |
4:1 |
| 8:1 |
4.4:0.56 |
5-15 |
89 |
8:1 |
e.DNase处理去除DNA模板。在20μl反应体系中直接加入1μl本试剂盒提供的DNase I,混匀后快速离心一下,将溶液沉淀至离心管底部。37℃孵育15分钟。
f.转录产物的纯化和凝胶电泳检测。通过酚氯仿抽提后乙醇或异丙醇沉淀RNA以纯化转录产物,或者使用适当的柱纯化方法纯化体外转录获得的RNA。可以通过常规的RNA电泳确认获得的转录产物的长度和纯度。
注:也可以在普通的RNA合成后再通过牛痘病毒加帽酶(Vaccinia virus capping enzyme, VCE)进行加帽反应,此时的加帽效率可以接近100%。
4.修饰RNA的合成。
本试剂盒可以按照如下方案合成生物素、地高辛、FITC或Cy3等标记的RNA或带有特殊修饰的RNA。修饰的NTP (Biotin-, Digoxigenin-, FITC-, Cy3- or Aminoallyl-NTP)与常规NTP推荐的摩尔比为1:3。以下反应体系假设使用修饰的UTP。
注:如果使用ψTP或m1ψTP,通常直接用于替换UTP。
a.解冻必要的试剂盒组分,混匀后快速离心一下,将溶液沉淀至离心管底部。
b.参考下表,设置反应体系。
| Reagent |
Volume |
Final Concentration |
| Nuclease-free Water |
(11.2-x)µl |
- |
| SP6 Reaction Buffer (10X) |
2μl |
1X |
| ATP (100mM) |
1μl |
5mM |
| GTP (100mM) |
1μl |
5mM |
| CTP (100mM) |
1μl |
5mM |
| UTP (100mM) |
0.7μl |
3.5mM |
| Modified-UTP (50mM) |
0.6μl |
1.5mM |
| Template DNA |
xµl |
0.05µg/μl |
| RNase Inhibitor |
0.5µl |
- |
| SP6 RNA Polymerase |
2µl |
- |
| Total Volume |
20µl |
- |
c.混匀后快速离心一下,将溶液沉淀至离心管底部。37℃孵育2小时。对于<100nt的转录产物,推荐使用2µg模板,并在37℃孵育4-16小时。
注1:可通过改变NTP和Modified-NTP的量来调节标准核苷酸与修饰核苷酸的比例。
注2:修饰核苷酸很多情况下会降低转录效率,与使用未经修饰的NTP进行转录相比,会获得更少的转录产物。通常,Biotin-NTP和Aminoallyl-NTP对转录产量的影响不太明显。而对于包含Fluorescein-NTP或Cy3-NTP的转录反应,预期产量会低一些。另外,由于分子量增大,含有修饰的核苷酸的转录产物的电泳迁移率也会有所降低。
注3:如果需要去除模板DNA,可以加入30μl Nuclease-free Water和1μl DNase I,混匀后在37℃孵育15分钟。
注4:标记的探针可以在-20℃下保存大约一年,更推荐在-80℃冻存,并须尽量避免反复冻融。
5.RNA产物的纯化。
通常,RNA转录产物的小量制备可以通过苯酚/氯仿抽提和乙醇沉淀或使用柱纯化的方法进行纯化。对于RNA大量制备的情况,色谱柱通常会更加便捷。对于需要精确控制转录产物长度的情况,建议使用凝胶电泳和切胶回收纯化的方法。采用凝胶过滤这样的柱纯化的方法,也可以实现对转录产物长度的控制。
a.苯酚/氯仿抽提和乙醇沉淀。
苯酚/氯仿提取和乙醇沉淀RNA转录产物通常是实验室常规操作去除蛋白质和大多数游离核苷酸的首选方法。
(a)加入160μl Nuclease-free Water将反应体积放大到180μl,再加入20μl 3M醋酸钠(pH5.2)或20μl 5M醋酸铵,充分混匀。加入等体积的苯酚/氯仿混合液(1:1)抽提一次(剧烈Vortex 20-30秒,随后14000g离心5-10min取上清),再用氯仿抽提1-2次(每次剧烈Vortex 20-30秒,随后14000g离心5-10min取上清)。
(b)用双倍体积的无水乙醇沉淀RNA,在-20℃至少孵育30分钟。随后14000g 4℃离心5-10min沉淀RNA。
(c)弃上清,用约500μl预冷的70%乙醇洗涤沉淀。
(d)用50μl DEPC水(DEPC-treated Water)或0.1mM EDTA重悬并溶解RNA,在-80℃储存。
b.柱纯化法。
柱纯化可以去除游离的核苷酸、蛋白及盐。
纯化时加入80μl Nuclease-free Water将反应体系补足至100μl,混匀。由于RNA产量较高,为了避免超过离心柱式RNA纯化柱的结合能力,需要对纯化柱的载量进行评估,再根据相应的产品说明书纯化RNA。根据需要,对于超大量的RNA,也可以考虑使用FPLC进行柱纯化。
c.凝胶回收纯化法
当需要高纯度和特定长度的RNA转录产物时,建议凝胶电泳后切胶回收纯化。凝胶电泳可以根据转录产物的长度选择琼脂糖凝胶和聚丙烯酰胺凝胶。
6.RNA转录产物的分析和检测。
a.紫外吸收定量分析。
通过测定A260计算体外转录获得的RNA的量,通过A260/280和A260/A230来判断获得的RNA的纯度。对于单链RNA,1 OD对应的RNA浓度为40μg/ml。
b.转录产物的凝胶电泳分析。
为了评估转录产物的长度,完整性和产量,可以使用适当的变性琼脂糖凝胶或变性聚丙烯酰胺凝胶进行电泳分析。大于200nt的转录产物可以使用变性琼脂糖凝胶进行电泳分析。小于200nt的转录产物可以使用变性聚丙烯酰胺凝胶(5-15%)进行电泳分析。凝胶电泳都应在变性条件下进行,以最大程度地减少RNA二级结构对电泳迁移率的影响。
(a)变性凝胶的制备
a)例如1%变性琼脂糖凝胶的配制:称取1g琼脂糖加入72ml Nuclease-free Water中,加热溶化后,加入10ml 10X MOPS Buffer。待琼脂糖冷却至50℃ -60℃,在通风橱中加入18ml甲醛(37%),混合均匀,倒胶。10X MOPS Buffer:0.4M MOPS (pH7.0), 0.1M Sodium Acetate, 10mM EDTA。
b)例如15%变性PAGE/尿素凝胶的配制:称取4.2g尿素溶于4.4ml Nuclease-free Water中,使尿素完全溶解。随后加入1.5ml 40% Acr/Bis Solution (丙烯酰胺:甲叉双丙烯酰胺=19:1)和1ml 10X TBE Buffer。使用前,加入100μl 10% APS(过硫酸铵)和10μl TEMED,补足Nuclease-free Water至终体积为10ml。混合均匀,倒胶。10X TBE Buffer:0.9 M Tris Base, 0.9M Boric Acid, 20mM EDTA。
(b)RNA的凝胶电泳
a)将0.2-1μg RNA样品与RNA Loading Buffer混合。
b)通过在65℃-70℃下加热5-10分钟使RNA样品和RNA Marker样品变性。
c)在上样之前适当混匀后快速离心一下,以把液体收集到管底。
d)通过用
NA-Red (D0128/
D0130)、
NA-Green (D0133/
D0135)或
NA-Green Plus (D0136)等核酸染料对凝胶染色后,使用凝胶成像系统进行拍照观察。
常见问题:
1.长链RNA转录产物的产量明显偏低。
如果转录产物是长链RNA (>0.3kb)),但其产量明显低于预期,则可能是DNA模板里包含的污染物抑制了RNA聚合酶的活性,或是DNA模板的浓度不正确,或者是DNA模板的3’端为3’突出的末端。
可以尝试以下方案解决:重新纯化DNA模板,建议用酚氯/仿抽提,并确保把残留的苯酚去除干净;对模板的浓度以及完整性进行确定;延长37℃反应时间;增加模板的用量;尝试T7或T3启动子和相应的RNA聚合酶;排除DNA模板的3’端为3’突出的末端。
2.短链转录产物产量明显偏低。
短链转录产物(<0.3kb)可以通过增加反应时间和增加模板的量来提高产量。反应时间可以延长至16小时或者使用2μg以上的模板将会有助于获得更多的转录产物。此外,线性化使用的内切酶需要确保不会产生3’端为3’突出的末端,这样很可能会导致转录产物的产量明显降低。
3.RNA转录产物出现明显降解。
如果RNA在变性的琼脂糖凝胶或聚丙烯酰胺凝胶电泳时发现有明显的降解现象,提示DNA模板或操作过程中可能被RNase污染了。被RNase污染的DNA模板会影响合成的RNA的长度和产量,导致长度变短和产量下降。如果模板DNA被RNase污染,需要对模板DNA进行苯酚/氯仿抽提,然后用乙醇沉淀,最后将DNA溶解于Nuclease-free Water中。同时操作过程中需要严格按照RNA的操作要求进行,避免RNase污染。个别情况也会出现DNA模板降解的情况,此时需要通过电泳分析排除相应的可能性。
4.出现比预期更长的RNA转录产物。
如果在变性凝胶中出现比预期更长的RNA转录产物,很可能是质粒DNA模板未被完全线性化。即使是很小量的未被充分消化的环状质粒,也能产生大量的长转录产物。转录反应前需检查模板DNA是否被充分线性化,如果确认含未线性化的质粒,需要再次进行限制性内切酶消化直至充分线性化,或者进行凝胶电泳切胶回收线性化的模板DNA。当RNA转录产物由于存在较强的二级结构而变性不充分时,也可能观察到较大的条带。
5.出现比预期更短的RNA转录产物。
如果在变性凝胶电泳时观察到比预期更短的RNA转录产物,可能是由于RNA转录酶过早终止。一些类似于SP6 RNA Polymerase终止信号的序列会导致RNA转录反应的提前终止。可以通过降低转录温度(如30℃)以增加长转录产物的比例,但总产量会降低。对于富含GC或有二级结构的模板,在42℃下孵育会增加长转录产物的产量。当RNA转录产物由于存在较强的二级结构而变性不充分时,也可能观察到较短的条带。
相关产品:
| 产品编号 |
产品名称 |
包装 |
| R7016S |
T7 Quick High Yield RNA Transcription Kit |
25次 |
| R7016M |
T7 Quick High Yield RNA Transcription Kit |
100次 |
| R7018S |
T7 High Yield RNA Transcription Kit |
25次 |
| R7018M |
T7 High Yield RNA Transcription Kit |
100次 |
| R7020S |
SP6 High Yield RNA Transcription Kit |
25次 |
| R7020M |
SP6 High Yield RNA Transcription Kit |
100次 |
| R0102-2kU |
RNase Inhibitor |
2000U |
| R0102-10kU |
RNase Inhibitor |
10000U |
| R0102-50kU |
RNase Inhibitor |
50000U |
| R0107 |
氧钒核糖核苷复合物(RNase抑制剂) |
2ml |
| R0108 |
氧钒核糖核苷复合物(RNase抑制剂) |
10ml |
| R7070S |
E.coli Poly(A) Polymerase |
100U |
| R7070M |
E.coli Poly(A) Polymerase |
500U |
| R7070L |
E.coli Poly(A) Polymerase |
2.5KU |
| R7070XL |
E.coli Poly(A) Polymerase |
10KU |
| R7075 |
Poly(A) Polymerase Tailing Kit |
50次 |
| R0021 |
DEPC水(DNase、RNase free) |
100ml |
| R0022 |
DEPC水(DNase、RNase free) |
500ml |
| D7062 |
SP6 RNA Polymerase |
500U |
| D7066 |
T3 RNA Polymerase |
500U |
| D7069 |
T7 RNA Polymerase |
1000U |
| R7012S |
T7 RNA Polymerase |
1KU |
| R7012M |
T7 RNA Polymerase |
5KU |
| R7012L |
T7 RNA Polymerase |
25KU |
| R7012XL |
T7 RNA Polymerase |
100KU |
| R7006S |
SP6 RNA Polymerase |
1KU |
| R7006M |
SP6 RNA Polymerase |
5KU |
| R7006L |
SP6 RNA Polymerase |
25KU |
| R7006XL |
SP6 RNA Polymerase |
100KU |
| R7009S |
T3 RNA Polymerase |
1KU |
| R7009M |
T3 RNA Polymerase |
5KU |
| R7009L |
T3 RNA Polymerase |
25KU |
| R7009XL |
T3 RNA Polymerase |
100KU |
| D0033 |
PCR纯化试剂盒/DNA纯化试剂盒 |
50次 |
| D0041S |
BeyoMag™磁珠法PCR/DNA纯化试剂盒 |
50次 |
| D0041M |
BeyoMag™磁珠法PCR/DNA纯化试剂盒 |
200次 |
| D7006 |
T4 DNA Ligase |
40,000U |
| D7008 |
T4 DNA Ligase |
200,000U |
| D7035 |
Klenow Fragment |
100U |
| D7073 |
DNase I |
200U |
| D7076 |
DNase I |
1000U |
| D7378-250µl |
ATP (100mM, Nuclease free) |
250µl |
| D7378-1ml |
ATP (100mM, Nuclease free) |
1ml |
| D7378-5ml |
ATP (100mM, Nuclease free) |
5ml |
| D7379-250μl |
CTP (100mM, Nuclease free) |
250µl |
| D7379-1ml |
CTP (100mM, Nuclease free) |
1ml |
| D7379-5ml |
CTP (100mM, Nuclease free) |
5ml |
| D7380-250μl |
GTP (100mM, Nuclease free) |
250μl |
| D7380-1ml |
GTP (100mM, Nuclease free) |
1ml |
| D7380-5ml |
GTP (100mM, Nuclease free) |
5ml |
| D7381-250μl |
UTP (100mM, Nuclease free) |
250μl |
| D7381-1ml |
UTP (100mM, Nuclease free) |
1ml |
| D7381-5ml |
UTP (100mM, Nuclease free) |
5ml |
| D7383-1ml |
NTP set (100mM each, Nuclease free) |
4×250µl |
| D7385-500μl |
NTP Mix (10mM each, Nuclease free) |
500μl |
| D7385-2ml |
NTP Mix (10mM each, Nuclease free) |
2ml |
| D7387-250μl |
NTP Mix (25mM each, Nuclease free) |
250μl |
| D7387-1ml |
NTP Mix (25mM each, Nuclease free) |
1ml |



 微信在线咨询
微信在线咨询


 图2.SP6 RNA聚合酶催化的基于SP6 Promoter的RNA转录反应示意图。其中SP6 Promoter之前可以有更多的序列。
图2.SP6 RNA聚合酶催化的基于SP6 Promoter的RNA转录反应示意图。其中SP6 Promoter之前可以有更多的序列。








 微信在线咨询
微信在线咨询











