


 微信在线咨询
微信在线咨询


| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| C0535-0.5ml | LipoRNAi™转染试剂 | 0.5ml | 515.00元 |
| C0535-1.5ml | LipoRNAi™转染试剂 | 1.5ml | 1319.00元 |
| C0535-7.5ml | LipoRNAi™转染试剂 | 7.5ml | 5315.00元 |
LipoRNAi™转染试剂(LipoRNAi™ Transfection Reagent)是碧云天最新研发的一种以纳米材料为基础的非常便捷高效的小RNA(包括siRNA、miRNA等)细胞转染试剂,达到甚至超过了国际主流小RNA转染试剂的转染效果。适用于把siRNA、miRNA或其它形式的单链或双链RNA或DNA小核酸转染到真核细胞中,也可以用于活体动物的siRNA、miRNA等小核酸转染以及用于基因治疗等。
LipoRNAi™转染试剂的纳米技术可保证其瞬时转染和稳定转染时的可靠性和稳定性。
LipoRNAi™转染试剂使用特别便捷,无血清培养液和小RNA及转染试剂可以直接混匀,室温孵育20分钟,即可直接加入到细胞培养器皿内,实现了细胞转染的便捷操作。
LipoRNAi™转染试剂对于常见的哺乳动物细胞具有非常高的转染效率、重复性好、操作简单、细胞毒性极低,对于贴壁细胞和悬浮细胞都适用,特别适用于难转染的贴壁细胞。LipoRNAi™转染试剂通常没有明显细胞毒性,从而在转染后大多数情况下无需进行细胞培养液的更换,很多情况下在转染约48小时后可以收集细胞进行靶向的目的蛋白的表达检测。对于有些半衰期比较长的目的蛋白需要在转染siRNA或miRNA后72-96小时,才能检测到蛋白水平的显著下降。
LipoRNAi™转染试剂经过对小鼠胚胎成纤维细胞NIH3T3、人胚胎肾细胞HEK293、宫颈癌细胞Hela、中国仓鼠卵巢细胞CHO等多种细胞的测试,转染效率可以达到80-90%左右。贴壁细胞转染试剂的比较和选择请参考:http://www.beyotime.com/support/lipo.htm。
LipoRNAi™转染试剂转染细胞时,不受培养液中血清和抗生素的影响,即可以在血清和抗生素存在的情况下进行细胞转染。
LipoRNAi™转染试剂的转染效果可以通过转染荧光标记的小RNA在荧光显微镜下进行快速鉴定,也可以结合Western检测结果进行判定。LipoRNAi™转染试剂转染FITC标记的靶向STIM1的siRNA转染效果参考图1和图2。
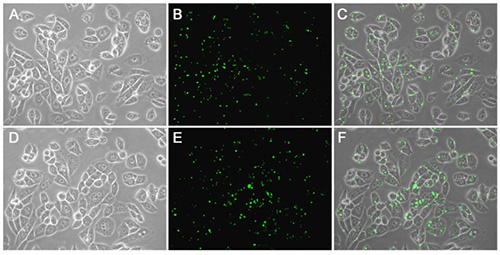
图1. LipoRNAi™转染试剂转染FITC标记的STIM1-siRNA至Hela细胞(A-C)或NIH3T3细胞(D-F)后4h的实拍图片。FITC标记的STIM1-siRNA均黏附于细胞膜上或已通过内吞(endocytosis)的方式进入细胞。 A、B和C分别为Hela细胞的明场图片、荧光图片和两者的叠加图片。D、E和F分别为NIH3T3细胞的明场图片、荧光图片和两者的叠加图片。NIH3T3细胞和Hela细胞均接种于六孔板,转染时每孔加入100pmol FITC标记STIM1-siRNA和4μl LipoRNAi™转染试剂的混合物。
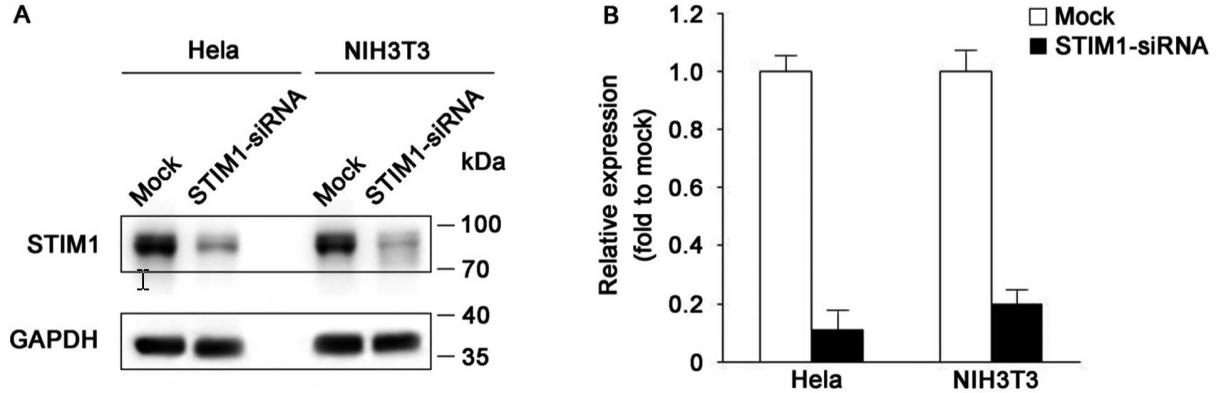
图2. LipoRNAi™转染试剂转染FITC标记的STIM1-siRNA至Hela或NIH3T3细胞48h后,通过Western blot检测STIM1蛋白的下调效果。Western blot所使用的STIM1抗体(AF2614 Stromal interaction molecule 1 Rabbit Monoclonal Antibody)按照说明书1:1000稀释,二抗辣根过氧化物酶标记山羊抗兔IgG(H+L) (A0208) 1:1000稀释。GAPDH为内参。A为Western blot的检测结果;B为A图及重复实验的灰度定量统计图。
每毫升本转染试剂大约可以转染10厘米培养皿40个、6厘米培养皿125个、6孔板250个孔、12孔板625个孔、24孔板1250个孔、48孔板2500个孔、96孔板6250个孔。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| C0535-0.5ml | LipoRNAi™转染试剂 | 0.5ml |
| C0535-1.5ml | LipoRNAi™转染试剂 | 1.5ml |
| C0535-7.5ml | LipoRNAi™转染试剂 | 5×1.5ml |
| — | 说明书 | 1份 |
保存条件:
4℃保存。长期不使用可以-20℃保存。
注意事项:
增加LipoRNAi™转染试剂用量容易导致转染效率下降,请优先按照推荐的转染试剂用量进行转染。如有必要再调整用量。
使用高纯度的小RNA等小核酸有助于获得较高的转染效率。
转染前细胞必须处于良好的生长状态。
经测试在使用本产品转染后4-6小时更换细胞培养液,并不会对转染效率产生显著影响。如有必要,完全可以在转染后4-6小时更换细胞培养液。
需自备不含抗生素的无血清培养液、Opti-MEM®培养液或普通的DMEM培养液。
LipoRNAi™转染试剂不能vortex或离心,宜缓慢晃动混匀。
LipoRNAi™转染试剂使用后请立即盖好盖子,避免长时间暴露在空气中,影响转染效率。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. siRNA转染:
a. 细胞培养(以六孔板为例,其它培养板或培养皿可参考六孔板):在转染前一天(18-24小时)按照每孔约20-70万细胞(具体的细胞数量据细胞类型、大小和细胞生长速度等而定)接种到六孔板内进行培养,使第二天细胞密度能达到约70-80%。
b. 在进行下述转染步骤前,把培养有细胞的六孔板每孔换成2ml新鲜培养液(含有血清和抗生素的完全培养液)。对于LipoRNAi™转染试剂,抗生素的存在不会影响转染效率,也不会在细胞转染后导致细胞毒性。
c. 参考下表,取一个洁净无菌离心管,对于待转染的六孔板中每一个孔的细胞,加入125µl不含抗生素和血清的DMEM培养液(高糖DMEM或低糖DMEM均可)或Opti-MEM® Medium,加入100pmol siRNA,并用枪轻轻吹打混匀;再加入4µl LipoRNAi™转染试剂,用枪轻轻吹打混匀,请特别注意不可vortex或离心。配制完成后,室温存放6小时内稳定。
| 96-well | 48-well | 24-well | 12-well | 6-well | 6cm dish | 10cm dish | |
| 无血清培养液或Opti-MEM® Medium | 5μl | 12.5μl | 25μl | 50μl | 125μl | 250μl | 750μl |
| siRNA | 4pmol | 10pmol | 20pmol | 40pmol | 100pmol | 200pmol | 600pmol |
| LipoRNAi™转染试剂 | 0.16μl | 0.4μl | 0.8μl | 1.6μl | 4μl | 8μl | 24μl |
| 加入siRNA后轻轻混匀,加入LipoRNAi™转染试剂后轻轻混匀,室温孵育20min (参考图3,时间不能少于20min)。 | |||||||
| 每孔加入的混合物的量 | 5μl | 12.5μl | 25μl | 50μl | 125μl | 250μl | 750μl |
| 按照上述用量每孔均匀滴加LipoRNAi™转染试剂和siRNA的混合物,直接继续培养,后续无需在数小时后更换培养液 | |||||||
注1:对于六孔板中一个孔的细胞,LipoRNAi™转染试剂的用量可以在2-6μl范围内进行适当调节(如果发现有细胞毒性,可以把LipoRNAi™转染试剂的用量在2-4μl范围内进行适当调节),siRNA用量可以在50-250pmol的范围内进行适当调节。通常siRNA用量(pmol)和LipoRNAi™ (μl)的用量比例为25:1,如有必要可以在10:1-40:1的范围内优化转染效果,上表推荐的比例为25:1,此时LipoRNAi™的用量相对较少,既经济又高效。最佳的转染条件,不同的细胞类型和培养条件有所不同,可以在上述推荐范围内自行优化转染条件。
注2:siRNA的推荐浓度为20µM,常用的浓度范围为10-50µM。
注3:对于多个孔转染相同数量相同小RNA的情况可以把每个孔所需的LipoRNAi™转染试剂和siRNA按照相应倍数加大用量,然后一起混合在同一个离心管内,后续混匀后,可以按照推荐用量滴加到细胞培养器皿内。
注4:对于其它培养板或培养器皿,各种试剂的用量可以按照细胞培养器皿的培养面积按比例进行换算。如果转染寡核苷酸或RNA等可以参考转染DNA的条件进行。
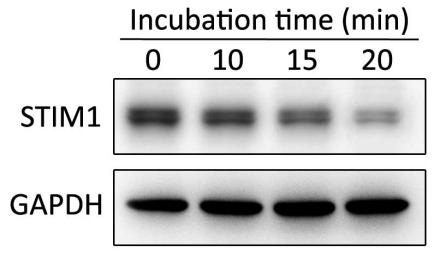
图3. LipoRNAi™转染试剂与siRNA不同孵育时间对于靶基因下调效果的影响。LipoRNAi™转染试剂与STIM1-siRNA孵育图中所示的时间后转染Hela细胞,48h后收集细胞通过Western blot检测STIM1蛋白的下调效果。Western blot所使用的STIM1抗体(AF2614 Stromal interaction molecule 1 Rabbit Monoclonal Antibody)按照说明书1:1000稀释,二抗辣根过氧化物酶标记山羊抗兔IgG(H+L) (A0208) 1:1000稀释。GAPDH为内参。
d. 无论是贴壁细胞还是悬浮细胞,按照六孔板每孔125µl LipoRNAi™转染试剂-siRNA混合物的用量,均匀滴加到整个孔内,随后轻轻混匀。
e. 继续培养约2天左右后,即可用适当方式检测siRNA对于靶基因的下调效果,例如qPCR、Western、ELISA、报告基因等。
常见问题:
1. 转染效率低:
a. 优化小核酸与LipoRNAi™转染试剂比例,对于难转染的细胞,可适当增加LipoRNAi™转染试剂的用量。
b. 应使用高纯度、无菌、无污染物的siRNA等小核酸进行转染。
c. 贴壁细胞转染时状态良好,细胞密度达70-80%时才可进行转染,过稀或过密都可能影响转染效率,不同细胞的最佳转染密度需要自行摸索。悬浮细胞宜在对数生长期进行转染。
d. 需使用无抗生素和无血清培养液配制LipoRNAi™转染试剂和siRNA等小RNA的混合物。
e. 转染后培养时间不足,而被误以为转染效率偏低。不同细胞转染后至显著表达所需要培养的时间通常为约48小时。
f. 检查细胞是否有支原体感染,支原体感染会影响细胞增殖,并很可能影响转染效率。
g. 使用传代次数相对较少的细胞,细胞传代次数太多,对转染效率会有一定的影响。
h. 如果没有检测到目的蛋白表达水平的变化,应该仔细核对转染用的小RNA等,确保测序结果和读码框完全正确。
i. 如果靶基因的敲减(knockdown)效果欠佳,应该考虑尝试设计不同的siRNA。
2. 出现一定程度的细胞毒性:
a. 转染前,细胞至少铺板18-24小时。
b. 减少siRNA用量,按照比例减少LipoRNAi™转染试剂。
c. 检查是否转染时细胞密度太低。
d. 检查细胞是否有支原体等微生物污染。
e. 在细胞培养4-6小时之后进行换液。
附录:
常用多孔板和培养皿的尺寸、培养面积、细胞培养量和推荐的培养体积等相关数据表:
| Multiple Well Plates or Dishes | Single Well Only for Plates | |||||
| Diameter (Bottom, mm)* | Growth Area (cm2)* | Average Cell Yield | Total Well Volume (ml) | Working Volume (ml) | Recommended Volume (ml) | |
| 6 well | 34.8 | 9.5 | 9.5 × 105 | 16.8 | 1.9-2.9 | 2 |
| 12 well | 22.1 | 3.8 | 3.8 × 105 | 6.9 | 0.76-1.14 | 1 |
| 24 well | 15.6 | 1.9 | 1.9 × 105 | 3.4 | 0.38-0.57 | 0.5 |
| 48 well | 11.0 | 0.95 | 9.5 × 104 | 1.6 | 0.19-0.285 | 0.25 |
| 96 well | 6.4 | 0.32 | 3.2 × 104 | 0.36 | 0.10-0.20 | 0.1 |
| 384 well | 2.7 | 0.056 | 5.6 × 103 | 0.112 | 0.025-0.050 | 0.030 |
| 1536 well | 1.63 × 1.63** | 0.025 | 2.5 × 103 | 0.0125 | 0.005-0.010 | 0.010 |
| 3.5 cm dish | 34 | 9 | 9.0 × 105 | NA | 1.8-2.7 | 2 |
| 6 cm dish | 52 | 21 | 2.1 × 106 | NA | 4.2-6.3 | 5 |
| 10 cm dish | 8.4 | 55 | 5.5 × 106 | NA | 11-16.5 | 12 |
| 15cm dish | 14 | 152 | 1.5 × 107 | NA | 30.4-45.6 | 35 |
| 24.5cm dish | 22.4 × 22.4** | 500 | 5.0 × 107 | NA | 100-150 | 120 |
*Diameter and growth area may vary depending on the manufacturer, and the listed sizes are from Corning.
**These wells or dishes are square.
相关产品:
| 产品编号 | 产品名称 | 产品包装 |
| C0508 | 磷酸钙法细胞转染试剂盒 | >200次 |
| C0511 | DEAE-Dextran细胞转染试剂盒 | >200次 |
| C0518-1ml | Lipo293F™转染试剂 | 1ml |
| C0518-10ml | Lipo293F™转染试剂 | 10ml |
| C0518-100ml | Lipo293F™转染试剂 | 100ml |
| C0521-0.5ml | Lipo293™转染试剂 | 0.5ml |
| C0521-1.5ml | Lipo293™转染试剂 | 1.5ml |
| C0521-7.5ml | Lipo293™转染试剂 | 5×1.5ml |
| C0526-0.5ml | Lipo6000™转染试剂 | 0.5ml |
| C0526-1.5ml | Lipo6000™转染试剂 | 1.5ml |
| C0526-7.5ml | Lipo6000™转染试剂 | 5×1.5ml |
| C0533-0.5ml | Lipo8000™转染试剂 | 0.5ml |
| C0533-1.5ml | Lipo8000™转染试剂 | 1.5ml |
| C0533-7.5ml | Lipo8000™转染试剂 | 5×1.5ml |
| C0535-0.5ml | LipoRNAi™转染试剂 | 0.5ml |
| C0535-1.5ml | LipoRNAi™转染试剂 | 1.5ml |
| C0535-7.5ml | LipoRNAi™转染试剂 | 5×1.5ml |
| C0551-0.5ml | LipoInsect™转染试剂 | 0.5ml |
| C0551-1.5ml | LipoInsect™转染试剂 | 1.5ml |
| C0551-7.5ml | LipoInsect™转染试剂 | 5×1.5ml |









 微信在线咨询
微信在线咨询











