微信在线咨询
微信在线咨询


| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| D6257S | DpnI | 500U | 249.00元 |
| D6257M | DpnI | 2.5KU | 1053.00元 |
| D6257L | DpnI | 10KU | 3158.00元 |
| D6257XL | DpnI | 50KU | 11828.00元 |
DpnI内切酶为碧云天最新研发产品,基本信息如下:
| 识别序列 | 缓冲液兼容性(%) | 酶切温度 | 失活条件 | 甲基化干扰? | |||||
| GA* ^TC CT ^A*G |
1X B | 1X G | 1X O | 1X R | 1X Y | 2X Y | 37℃ | 80℃ 20min |
甲基化的序列 才可被酶切 |
| 100 | 100 | 50-100 | 50-100 | 100 | 50-100 | ||||
*,该位点甲基化后才可以被DpnI所识别并酶切。
DpnI识别并酶切DNA双链中腺嘌呤N6位甲基化(N6-methyladenine)的GATC序列。DpnI识别位点中两个腺嘌呤的N6位都甲基化时,呈现正常的酶活力;只有一个腺嘌呤的N6位甲基化时,酶切活力会降低约60倍。
从dam+(Dam甲基化酶表达阳性)大肠杆菌菌株如DH5α等提取的质粒的GATC序列中腺嘌呤N6位被甲基化,从而可以被DpnI识别和酶切;而从dam-(Dam甲基化酶表达阴性)大肠杆菌菌株如JM110等提取的质粒的GATC序列中腺嘌呤N6位没有被甲基化,从而不能被DpnI识别和酶切(参考图1)。
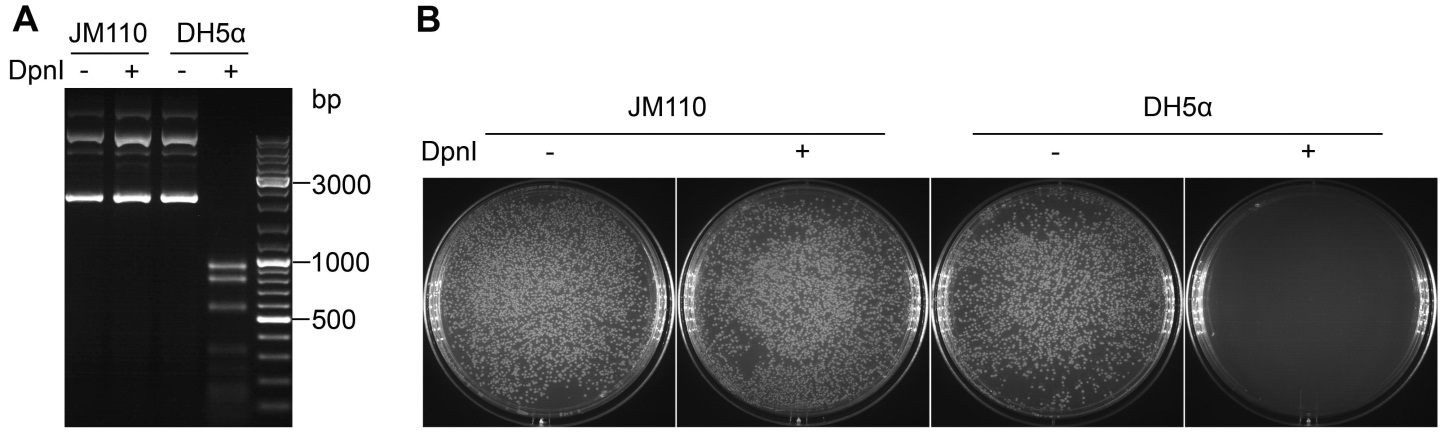
图1. DpnI (D6257)酶活性检测结果图。A.分别用从JM110菌株(dam-)和DH5α菌株(dam+)中提取的质粒400ng,在20μl酶切体系中,分别加入或不加入10U的DpnI,37℃酶切1小时,然后电泳分析。图中可见从DH5α中提取得到的甲基化质粒可以被DpnI完全消化,而对于从JM110中提取得到的非甲基化质粒没有任何非特异性的酶切作用。B.取图A中各酶切产物5μl分别转化DH5α感受态细胞然后涂板,培养过夜。图中可见从DH5α中提取得到的甲基化质粒被DpnI消化1小时后,不会产生任何克隆,进一步验证了DpnI在1小时内可以完全消化甲基化的质粒,并确保本产品可以用于质粒点突变。
酶储存液组成为:10mM Tris-HCl (pH7.4 at 25℃),300mM NaCl,1mM DTT,0.1mM EDTA,0.5mg/ml BSA and 50% glycerol。
1X Buffer Y组成为:33mM Tris-acetate (pH7.9 at 37℃),10mM magnesium acetate,66mM potassium acetate,0.1mg/ml BSA。
酶切和连接效率:50倍过量的本内切酶消化1小时,>70%被酶切的pBR322 DNA片段可以重新连接,这些片段>95%可以被重新酶切(recut)。
活性单位定义:在37℃,50微升反应体系中反应1小时,将1微克的λDNA完全分解的酶量定义为1个活性单位,即1U。
包装清单:| 产品编号 | 产品名称 | 包装 |
| D6257S-1 | DpnI (10U/µl) | 500U |
| D6010Y | 10X Buffer Y | 1ml |
| - | 说明书 | 1份 |
| 产品编号 | 产品名称 | 包装 |
| D6257M-1 | DpnI (10U/µl) | 2.5KU |
| D6010Y | 10X Buffer Y | 1ml |
| - | 说明书 | 1份 |
| 产品编号 | 产品名称 | 包装 |
| D6257L-1 | DpnI (10U/µl) | 10KU |
| D6010Y-4ml | 10X Buffer Y | 4ml |
| - | 说明书 | 1份 |
| 产品编号 | 产品名称 | 包装 |
| D6257XL-1 | DpnI (10U/µl) | 50KU |
| D6010Y-20ml | 10X Buffer Y | 20ml |
| - | 说明书 | 1份 |
-20℃保存,至少两年有效。
注意事项:内切酶使用时宜存放在冰盒内或冰浴上,使用完毕后宜立即放置于-20℃保存。
如果发现预期的酶切位点不能切开,请确认特定位点是否已经被甲基化。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. 单酶切时可以参考如下反应体系进行:
| 待酶切DNA | 不超过1μg |
| 双蒸水或Milli-Q水 | 适量 |
| 10X Buffer Y | 2μl |
| DpnI | 0.5-1μl |
| 总体积 | 20μl |
| 37℃孵育1小时或更长时间 | |
说明:请注意把Buffer和水等充分混匀后再加入内切酶,加入内切酶后可以用枪吹打或轻轻Vortex混匀。通常参考上述条件孵育1小时已经足够,但多孵育数小时甚至孵育过夜也不会产生负面影响。如果酶切较长时间甚至酶切过夜,可以使用更少量的酶。待酶切DNA量较大时,可以适当延长酶切时间或按比例放大酶切体系。
2. 双酶切或多酶切时,需选择适当的可以兼容两个或多个内切酶的缓冲液,然后参考上表设置反应体系。如果没有合适的缓冲液可以选择,可以在一种酶消化完毕后进行纯化,纯化完毕后再进行另外一种酶切反应。









 微信在线咨询
微信在线咨询